2024年6月18日🏊,意昂4体育平台李力課題組,醫意昂4附屬仁濟醫院薛婧課題組在 Advanced Science 上在線發表了題為“Multilevel regulation of NF-κB signaling by NSD2 suppresses Kras-driven pancreatic tumorigenesis”的研究論文。該研究揭示了 NSD2 作為腫瘤抑製因子,通過多種機製調節 NF-κB分子信號轉導途徑進而抑製胰腺腫瘤進程的分子機製🕺🏼。

胰腺導管腺癌(PDAC)是常見的消化系統惡性腫瘤之一,它發病隱匿,惡性程度高🔥,預後差👨🏼🏭,生存期短,其 5 年生存率不足 13%,中位生存期低於 6 個月[1]。更令人擔憂的是🍐,預計胰腺癌將在 2040 年之前超越結直腸癌,僅排在肺癌之後,成為癌症相關的主要死亡原因[2]💑。胰腺腫瘤發生發展涉及多種基因變異🦯,包括 KRAS、TP53、SMAD4 和 CDKN2A等♗。其中,90% 左右的PDAC 患者存在 KRAS 突變[5]。
NSD2 作為一種組蛋白賴氨酸甲基轉移酶🧑🏽🦳,主要負責催化組蛋白 3 賴氨酸 36產生二甲基化(H3K36me2)[6]。大量研究表明🧉,多種惡性腫瘤中可見 NSD2 的異常表達,其可能機製包括 Nsd2 的轉位/擴增/缺失/突變👨🏻🦯➡️,提示 NSD2 在癌症發生發展中起著重要作用[6]。據報道📐,多發性骨髓瘤中的 NSD2 t (4;14) 染色體易位與 NSD2 異常高表達有關,並導致預後不良[7,8]💃🏿。NSD2 在侵襲性前列腺癌中高表達💼,並且與前列腺癌患者的預後不良有關[9]。在其他腫瘤類型中也有類似的結果報道,例如食管癌、胃癌、肝細胞癌、肺癌和子宮體惡性腫瘤等[6]。許多研究發現 NSD2 促進細胞增殖📠、遷移、侵襲和上皮-間質轉化 (EMT),證明其起著至關重要的促癌作用[6,10,11]。然而,NSD2 在胰腺腫瘤發生過程中的作用和機製仍不清楚。
在該研究中,首先🐨,研究人員對臨床數據庫進行分析🤶🏼,相較於正常胰腺組織,NSD2 mRNA水平在PDAC患者腫瘤組織中降低, 提示NSD2在胰腺癌中的功能可能與以往其它癌種報道的促癌功能不一致,引起了研究人員的興趣。接著🚈,研究人員利用 KrasG12D 誘導的胰腺腫瘤小鼠模型,發現 NSD2在胰腺中特異過表達可抑製小鼠的炎症和 Kras G12D 誘導的腺泡導管化生。反之,NSD2在胰腺特異性缺失則促進 Kras G12D 誘導的腫瘤發生💧。
IκBα是NF-κB重要的核外負調控蛋白🚇,抑製NF-κB 中的主要成員 p65 的入核👈🏼⏏️。分子機製研究表明🦾,NSD2可直接通過 H3K36me2修飾促進 IκBα的轉錄表達。更有意思的是,NSD2還可以與 p65 蛋白的 DNA 結合域相互作用,從而直接抑製了 NF-κB 下遊轉錄活性。此外,利用SN50和JSH-23抑製 NF-κB 信號傳導可緩解 Nsd2 缺陷PDAC小鼠的腫瘤病變表型🤵🏼♂️,並使 Nsd2 缺陷型 PDAC 對吉西他濱治療更加敏感。最後🪣,研究人員利用臨床PDAC數據庫和樣品📫,進一步證實了PDAC 患者的 NSD2 表達降低🫄,其表達水平與核內p65水平呈負相關。
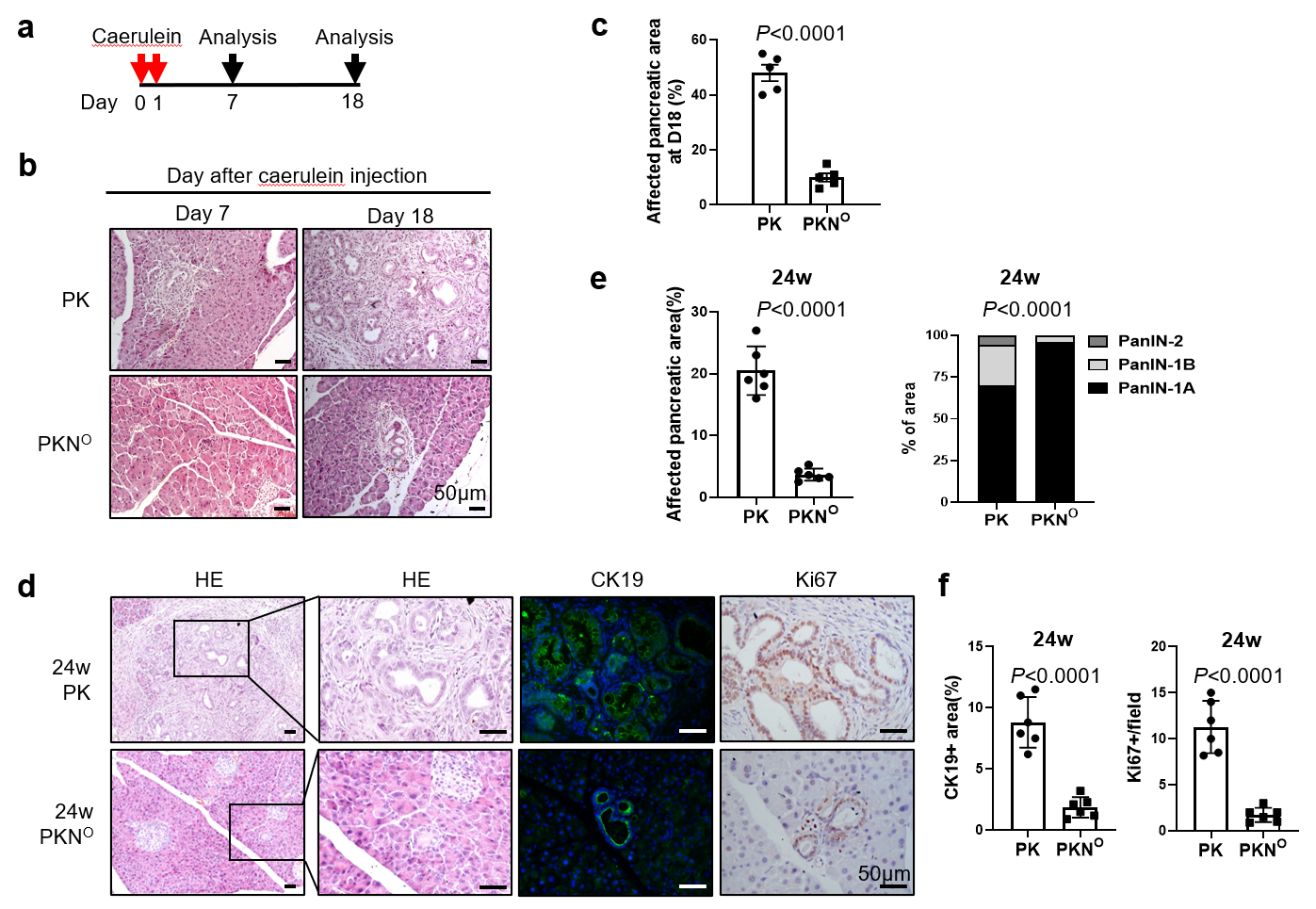
圖1 NSD2 抑製炎症和 Kras G12D 誘導的胰腺腫瘤進程
由此©️,研究人員揭示了 NSD2 在胰腺腫瘤發生過程中對 NF-κB 分子信號傳導途徑的多層次調控機製。這項研究揭示了NSD2的一種新的腫瘤抑製作用機製。同時也為 NSD2 低表達/缺失的 PDAC 患者通過吉西他濱和 NF-κB抑製劑聯合治療提供了新的理論思路💆🏼♀️。
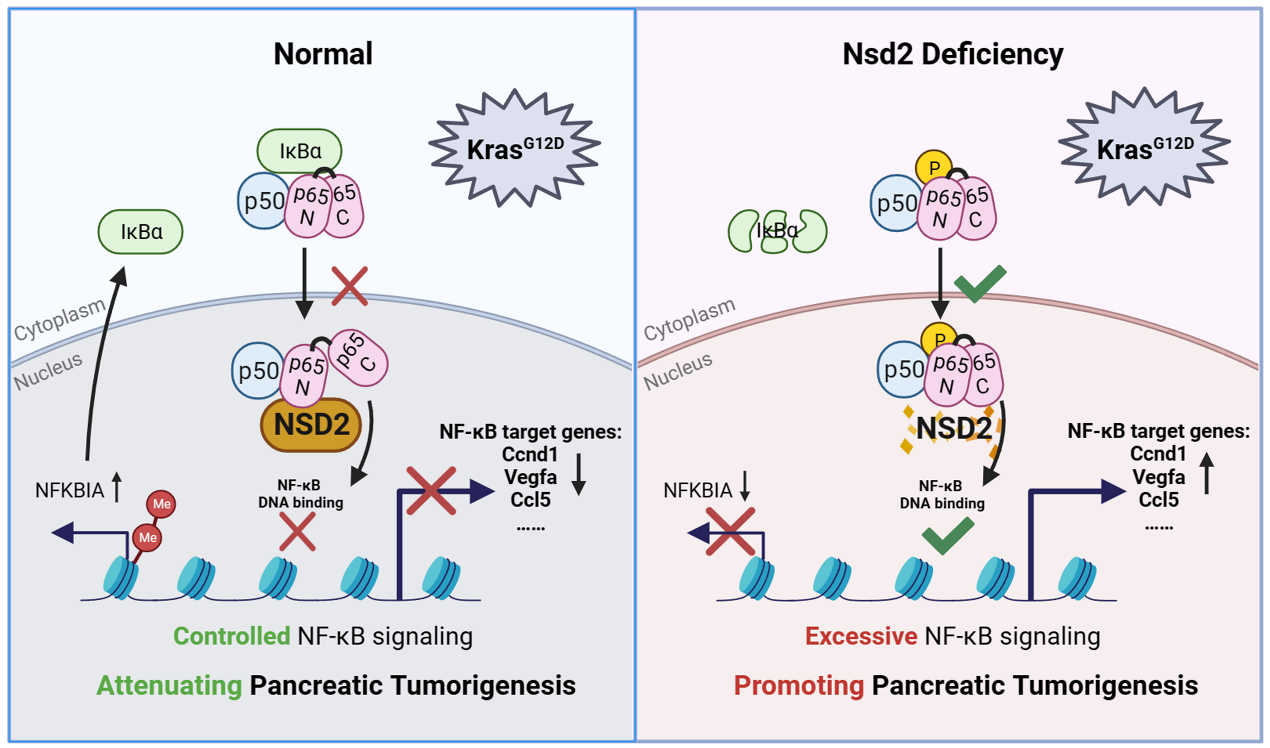
圖2 NSD2 多水平調控 NF-κB 信號通路抑製胰腺腫瘤進程
意昂4体育平台博士研究生馮文心和醫意昂4附屬仁濟醫院牛寧寧副研究員為該論文的共同第一作者👨🏽🔬;李力研究員和薛婧研究員為該論文的共同通訊作者🤫。該研究工作得到了國家重點研發計劃、國家自然科學基金委以及上海市科學技術委員會的支持。
原文鏈接: https://onlinelibrary.wiley.com/doi/10.1002/advs.202309387
供稿單位🥱📵:科研與學科辦
作者🤱🏽:李力團隊
審核🧚🏼:古宏晨、丁顯廷