關節軟骨損傷是臨床上最為常見的關節退行性疾病👩🏻🚒,尤其在中老年人群中發病率極高(65歲以上發病率大於69%),累及人群巨大👮🏿♀️,嚴重影響中老年人的生活質量🙅♀️。針對局限性軟骨缺損的中度退變患者,臨床上主要采用微骨折術或自體軟骨移植術進行治療,但是該類手術僅限於小範圍的軟骨缺損修復🖖,且供體來源十分有限,特別是移植軟骨與周圍正常軟骨整合欠佳(馬塞克現象)🈵。
最新研究結果表明,組織工程與再生醫學技術為解決上述難題提供了全新的治療策略。軟骨組織工程是通過結合自體軟骨細胞和三維支架材料(如水凝膠材料)進行關節軟骨缺損修復的先進技術🕑。隨著微創手術的普遍應用,基於水凝膠材料的軟骨組織工程技術能否與關節鏡手術結合使用一直是臨床醫生關註的焦點問題👳♀️。由於關節鏡手術需要在一定的水壓(~10 kPa)下實施操作🧑🏿💻😛,這對於當前的水凝膠材料無疑提出了巨大的挑戰⚧:水凝膠材料需要通過關節鏡裝置準確註射至缺損部位並在水下快速固化🚴♂️,固化後需要與周圍組織牢固粘合且在水壓環境維持機械穩定性🥻🧘🏽。迄今為止,沒有任何一項水凝膠技術能夠突破這一技術壁壘🙋🏼。
近期,意昂4体育平台林秋寧研究員、意昂4平台附屬第九人民醫院周廣東研究員聯合設計了一種超快、高強、強粘的雜化光交聯水凝膠技術(如圖一)。該類水凝膠技術能夠滿足關節鏡手術實施軟骨缺損修復的苛刻要求,即在水壓環境下實現光固化操作,並通過負載自體軟骨細胞的水凝膠支架材料,成功實現了大動物(豬)負重區關節軟骨缺損修復✒️。
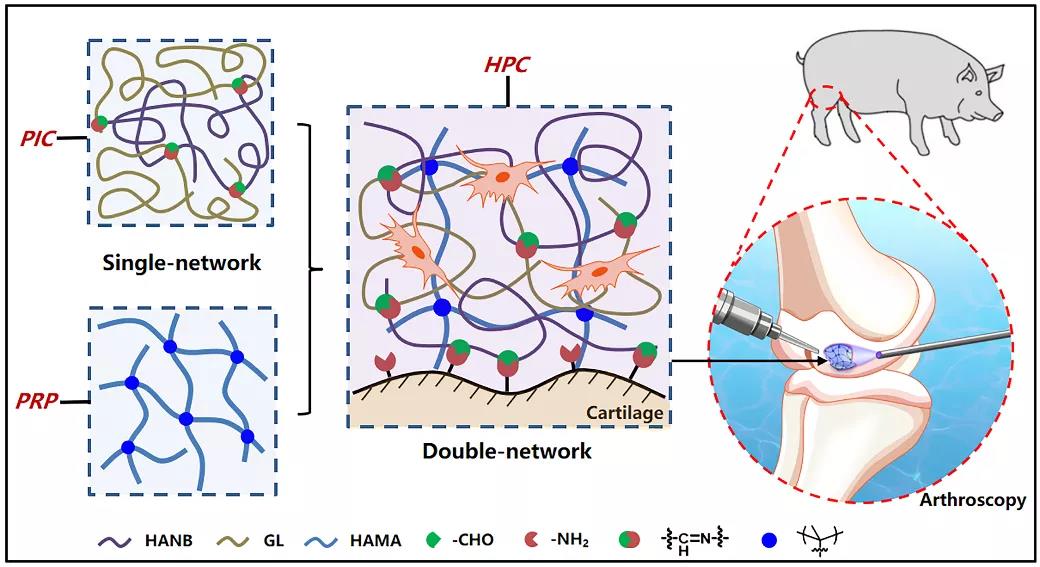
圖1 雜化光交聯水凝膠技術的構建示意圖
該研究團隊在“光偶合交聯”技術構建水凝膠材料多年的經驗與基礎上👸🏿,通過結合光致亞胺交聯策略和傳統的光引發自由基聚合交聯策略,構建了秒級固化、高強🙆、高粘的雙網絡光交聯水凝膠:1)透明質酸高分子上雙建官能團的快速聚合交聯(第一重網絡)👨🏼🔬;2)另一透明質酸高分子上的鄰硝基苄醇在光照下生成的醛基與明膠上的氨基發生亞胺交聯(第二重網絡)。同時,光致亞胺交聯賦予的組織粘附力(Adv. Mater. 2016, 28, 2724)能夠有效實現與周圍組織的化學鍵鍵合固定。
進一步,系統地研究並表征了雜化光交聯水凝膠的理化特性👩🏿🏫。實驗結果表明🤹🏼♀️:該類凝膠技術具有超快的交聯速度(約1 s🪈;如視頻一)♟、較高的力學性能(約2 MPa)、以及較高的組織粘附能力(凝膠-軟骨界面強度:縱向拉伸力16.4±1.2 kPa;橫向剪切力29.0±3.2 kPa;如圖二)🏋🏿♂️。同時,該類凝膠技術具有優異的生物相容性和生物降解性,以及較低的免疫炎症反應🦹🏽♂️🙅🏽♂️,結合軟骨細胞的水凝膠材料🍵,能夠在裸鼠皮下再生成熟的組織工程軟骨🍪👖。
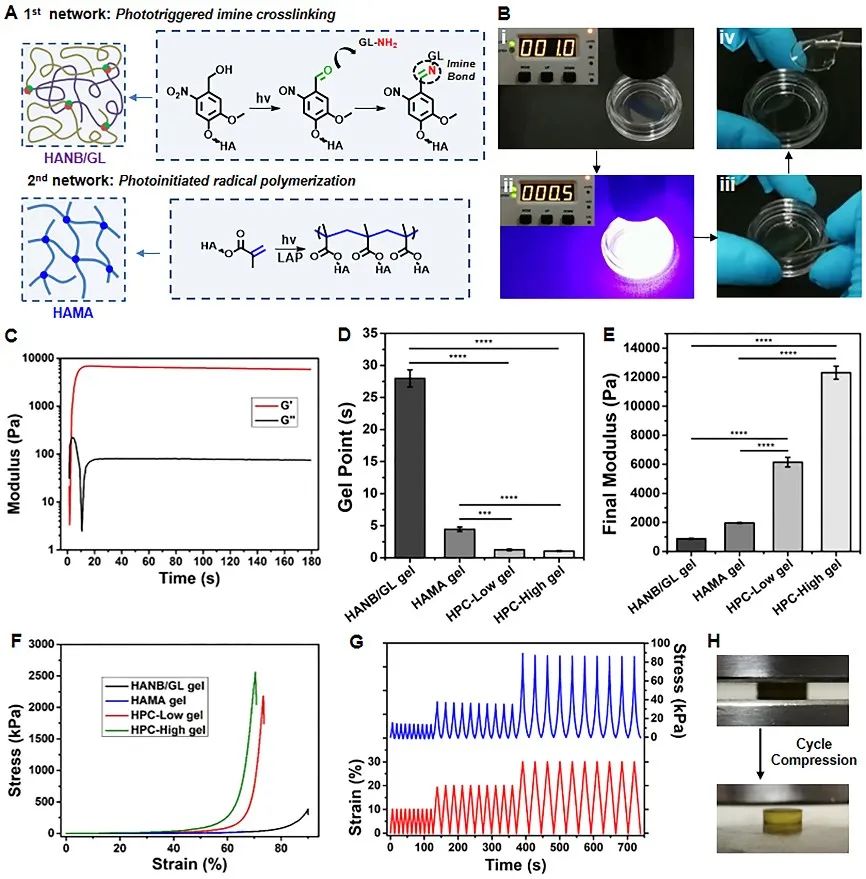
圖2 雜化光交聯水凝膠的理化特性表征
接著,重點探討了雜化光交聯凝膠技術結合關節鏡手術實施水下原位軟骨缺損修復的可行性。實驗中,水凝膠前體溶液可以結合為該技術量身定製的關節鏡輔助裝置🎆,方便地註射至水下的軟骨缺損部位🪤,並隨即打開395 nm光源照射,實現快速固化並與周圍軟骨組織一體化整合(如視頻二)🛅🧛🏻♀️。同時,固化後的凝膠-軟骨復合物能夠承受47.8±6.5 kPa強度的水壓,這遠遠超出了臨床上關節鏡手術所需的水壓(~ 10 kPa)。
最後📍,應用雜化光交聯水凝膠包裹自體軟骨細胞實施了在體關節鏡手術,並成功修復了豬關節負重區的軟骨缺損👦🏽。與體外模擬實驗結果一致🏀,該類水凝膠技術可以在連續液體(生理鹽水)灌溉壓力(~ 10 kPa)下,精準修補軟骨缺損(如視頻三)👩🏽✈️。修復6月後,關節軟骨缺損基本被新生的透明軟骨組織覆蓋,呈現出軟骨特異性染色和典型的軟骨陷窩結構,並且與周圍正常軟骨組織實現一體化整合(如圖三)。綜上所述,該類凝膠技術集可控快速交聯𓀍、優異機械性能以及可組織粘附的特性,滿足關節鏡手術水壓環境下的應用要求,有望拓展成為微創手術盛行趨勢下軟骨缺損治療的新策略👨🏻🦽➡️👩🦼➡️。
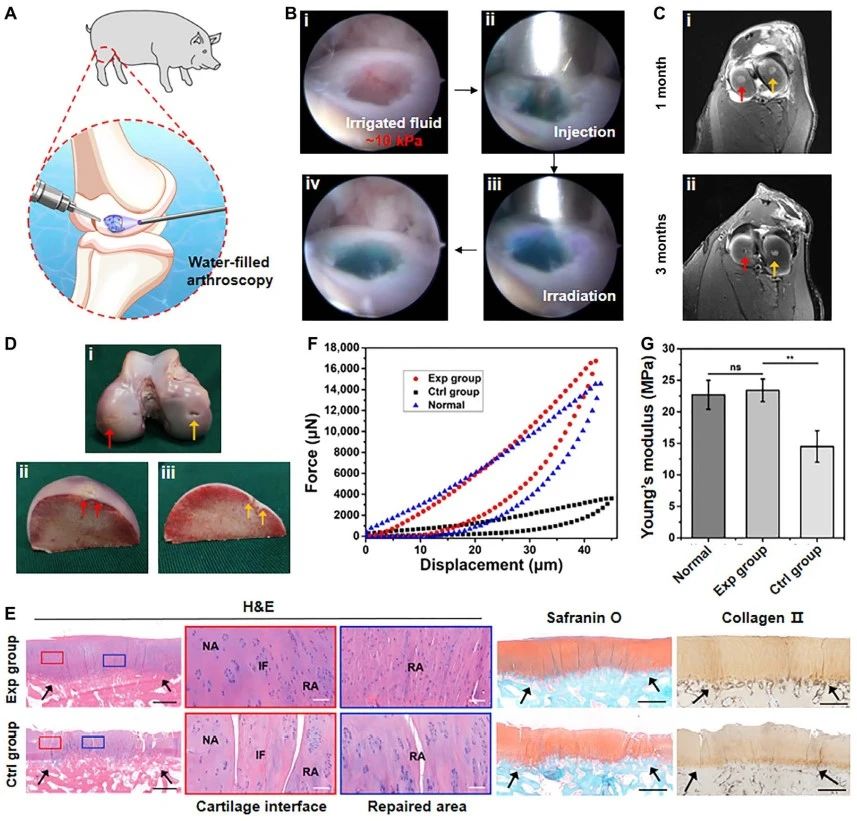
圖3 雜化光交聯水凝膠技術用於關節鏡手術下的在體軟骨缺損修復
相關論文“Ultrafast, tough, and adhesive hydrogel based on hybrid photocrosslinking for articular cartilage repair in water-filled arthroscopy”已被《Science Advances》在線刊登🤹🏻。華宇傑博士💁♂️、夏會堂博士及賈立濤為共同一作,周廣東研究員、林秋寧研究員為通訊作者。該工作得到了意昂4平台朱麟勇教授的悉心指導👩🏻✈️,意昂4平台附屬第六人民醫院趙金忠主任團隊的大力支持💂♀️🪔,以及國家重大研發計劃(2019YFA0110500 、2017YFC1103900)🪆🏊🏿、國家優秀青年科學基金(22022506)等項目支持。