GUT | 李力組合作研究揭示組蛋白甲基化酶SETD2協同Kras調控胰腺癌發生發展
2019年7月11日✶,意昂4体育平台李力課題組,醫意昂4附屬仁濟醫院薛婧課題組和孫勇偉課題組,在GUT雜誌上發表了題為Loss of Setd2 promotes Kras-induced acinar-to-ductal metaplasia and epithelia-mesenchymal transition during pancreatic carcinogenesis的研究工作📫,證實了SETD2缺失協同KRAS促進胰腺癌發生發展🧶🤵,並闡明了SETD2在胰腺癌起始和轉移兩個階段的不同功能和機製。
胰腺癌被稱為“癌中之王”,惡性程度高🙅🏻♀️、發展和惡化速度快,確診時多為晚期,且至今沒有特別有效的治療方法,從而具有較高的死亡率。因此針對其發病機製的研究極為迫切🧔🏿♂️。90%以上的胰腺癌由外分泌細胞產生,即為胰腺導管腺癌(Pancreatic ductal adenocarcinoma, PDAC)🛼。起始和轉移是PDAC發生發展過程中最重要的兩個階段🕎。炎症和Kras突變均可導致腺泡導管化生(Acinar to Ductal Metaplasia,ADM),且在Kras持續激活的情況下不可逆進展。目前ADM被認為是PDAC起始的重要事件。在抑癌基因失調或炎症🍬、毒性等刺激的情況下,癌前病變的導管樣細胞會進一步進展為PDAC💪🏽。胰腺腫瘤容易發生遠端轉移,是胰腺癌患者死亡的主要原因🎍。上皮間質化(Epithelial-Mesenchymal Transdifferentiation👏🏼,EMT)是癌細胞轉移的第一事件。表觀調控異常是惡性腫瘤的重要特征之一,近年來已發現胰腺腫瘤中也大量存在表觀修飾異常,但相關機製和功能研究仍比較欠缺🏂🏼。
組蛋白甲基轉移酶SETD2(SET domain-containing protein 2)🏊🏻♀️,是目前已知H3K36me3形成的唯一三甲基化酶。目前已知SETD2/H3K36me3主要功能包括參與DNA損傷修復,維持染色質活躍狀態、協助轉錄延伸從而促進基因轉錄水平💌。血液腫瘤、胃腸道間質瘤👨👩👦、結腸癌、神經膠質瘤🌼、乳腺癌等中均發現SETD2的突變和其抑癌功能🧧🎪,可見SETD2-H3K36me3是腫瘤中常見的一種抑癌機製,但調控機製具有腫瘤組織的特異性。已有二代測序發現胰腺癌患者同樣攜帶一定比例的SETD2突變,然而其在胰腺腫瘤中的功能和機製尚未明確。
李力副研究員在2014年建立了Setd2條件性基因敲除小鼠模型並在生殖、發育和癌症等領域展開廣泛的功能研究(Zuo et al, J Bio Chem, 2018;Wang et al, PLoS Biol, 2018;Xu et al, Nat Genet, 2019)🛄。合作組由此展開進一步研究🤳🏽,結合共用數據庫和臨床樣本,發現SETD2和H3K36me3表達與胰腺癌患者預後顯著負相關🙍🏿♂️。通過構建胰腺特異性敲除Setd2,以及聯合Kras突變的小鼠,發現SETD2缺失可以大大促進KRAS誘導的胰腺癌進程。分別對腺泡細胞以及胰腺癌細胞Setd2野生型和Setd2缺失的樣本進行高通量的表達譜和H3K36me3 ChIP聯合分析,發現兩個病理階段中Setd2通過調控不同下遊基因而發揮作用:1)起始階段-調控MYC蛋白的E3泛素連接酶Fbxw7表達,影響腺泡細胞穩態🤵🏻♂️,從而促進ADM發生;2)轉移階段:調控Ctnna1粘連蛋白的表達👂🏻,影響E-cadherin穩定性,從而促進EMT及轉移 🍞。
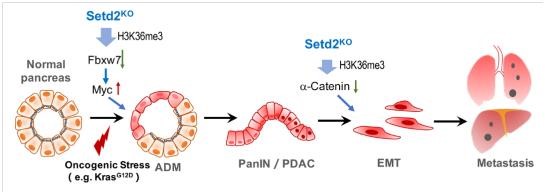
不同病理時期的差異性調節機製🧗🏻♀️,賦予Setd2在復雜疾病中的不同生物學功能🧑🦲,從而更加精準的調控病理過程。本研究首次揭示了SETD2-H3K36me3表觀調控元件協同Kras突變在胰腺癌中的功能與分子機製🍟,深入了我們對其病理機製的認識👨👩👧👧,為胰腺癌靶向治療提供了新的思路。
牛寧寧副研究員和路平博士為該論文的共同第一作者🏇🏼;薛婧研究員、李力副研究員和孫勇偉主任為該論文的共同通訊作者💁🏽♀️。
原文鏈接: