該研究首次發現一組化學小分子藥物可在體外及原位高效誘導擴增肌肉幹細胞,成功實現老齡化和杜氏肌肉營養不良型病損肌肉組織的修復👩🏽🎨。

肌肉是人體最豐富的組成部分(約占體重的40%)🐝,對維持機體運動和生命健康至關重要🙇🏿。在正常情況下,如果肌肉發生損傷,位於肌纖維基底膜和質膜之間的靜息狀態的肌肉幹細胞(亦被稱為衛星細胞)會被激活,並增殖分化產生新的肌纖維,進而修復受損肌肉。盡管成人肌肉幹細胞具有強大的再生潛能,然而,由於老齡化肌肉萎縮和杜氏肌營養不良症(DMD)等疾病引起的漸進性肌肉壞死,往往會導致肌肉幹細胞的再生修復能力下降或者完全喪失🤷♂️⛺️,最終導致病人癱瘓𓀑,甚至死亡。
近年來,幹細胞技術為衰老或DMD等肌肉疾病的治療帶來了巨大希望,但仍然面臨一個重大的挑戰是難以實現肌肉幹細胞的分離🪆、體外培養和大量擴增,從而導致肌肉幹細胞的供應不足👃🏽,嚴重限製了幹細胞療法的臨床應用💂🏽。
為了解決這一臨床上的重大關鍵問題,研究團隊通過篩選大量的小分子藥物,首次發現forskolin(一種腺苷酸環化酶-cAMP激活劑)與 RepSox (一種選擇性TGFβR-1/ALK5抑製劑)兩種小分子藥物組合“雞尾酒”可選擇性、高效誘導擴增皮膚來源肌肉幹細胞❤️,並發現這種小分子組合藥物可同樣有效誘導老年肌肉組織來源的幹細胞的體外擴增(圖1)。

圖1. 小分子藥物誘導擴增皮膚來源的肌肉幹細胞
研究團隊進一步采用蛇毒細胞毒素(CTX)損傷的成年👈、老年小鼠及肌肉營養不良DMD小鼠的脛骨前肌為動物模型🤶🏼,開展了體外誘導幹細胞註射治療肌肉的體內實驗🧑🏻🦽。當把體外小分子誘導擴增的皮膚來源的肌肉幹細胞註射到三種動物模型損傷肌肉中,一個月後🧉,移植的幹細胞可以生成新的肌肉纖維,並成功融合到損傷肌肉中,顯著地促進肌肉的功能性修復。
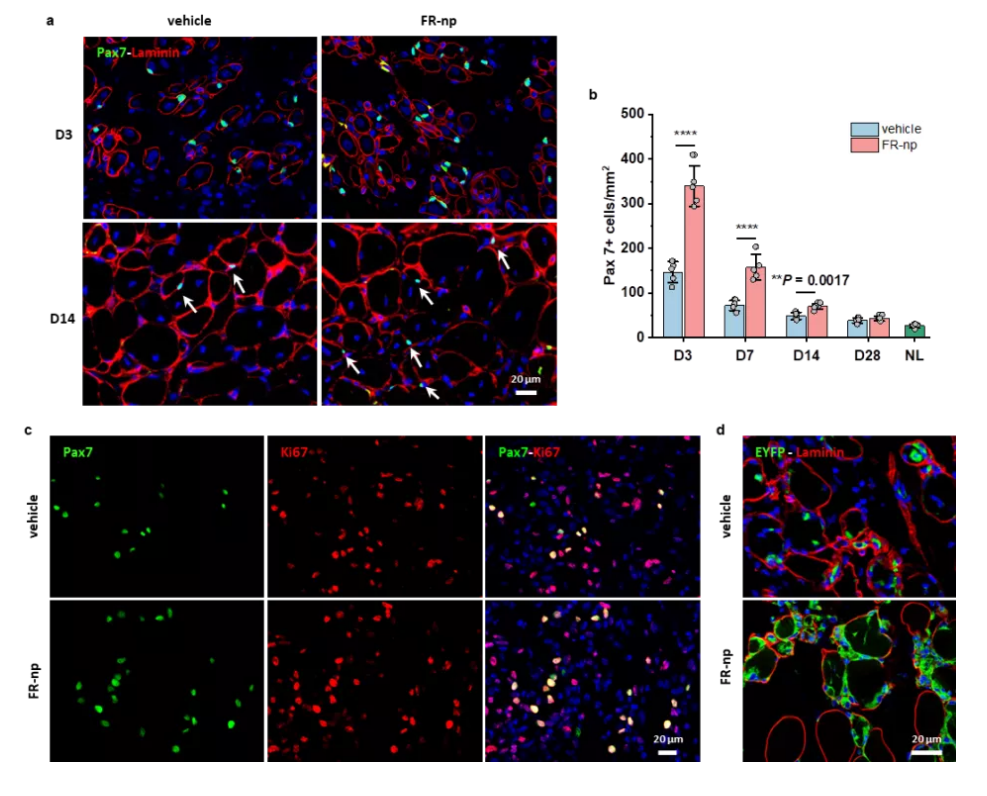
圖2. 註射小分子藥物體外誘導擴增皮膚來源的肌肉幹細胞促進肌肉修復
接著,為了實現更加簡單、便利的治療肌肉疾病🧚🏿♂️,研究團隊把小分子組合藥物載入生物可降解納米顆粒,實現藥物可控釋放,並把載藥顆粒註射到受損肌肉部位🦙,發現可顯著地刺激組織駐留的原位肌肉幹細胞的擴增💜,成功地實現了成年小鼠和老年小鼠肌肉的原位再生修復(圖3&4)。
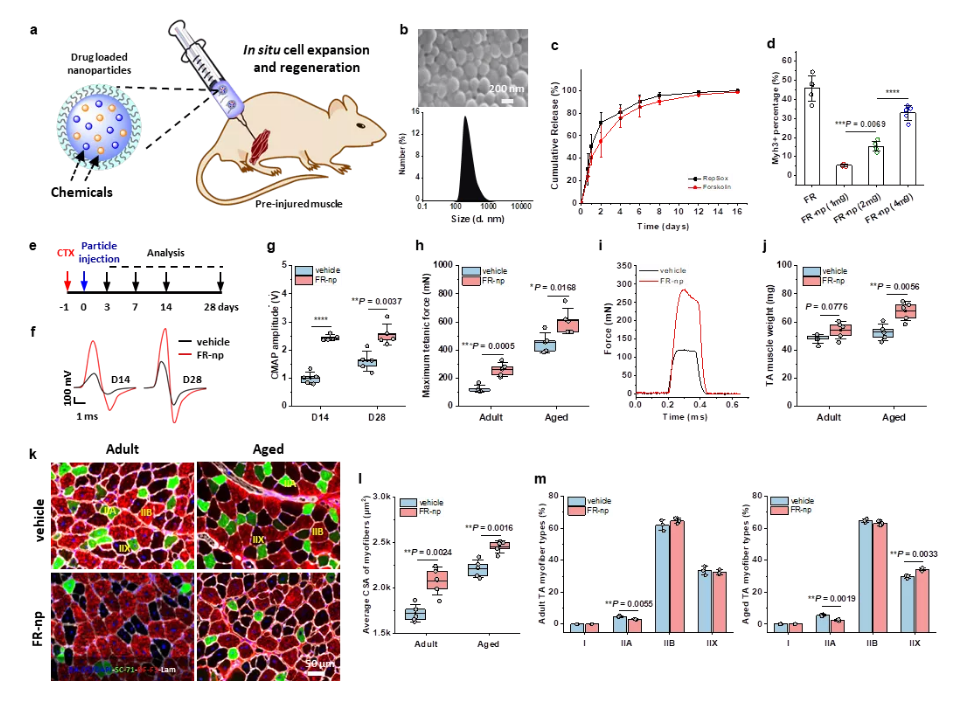
圖3. 載小分子藥物納米顆粒促進肌肉修復再生
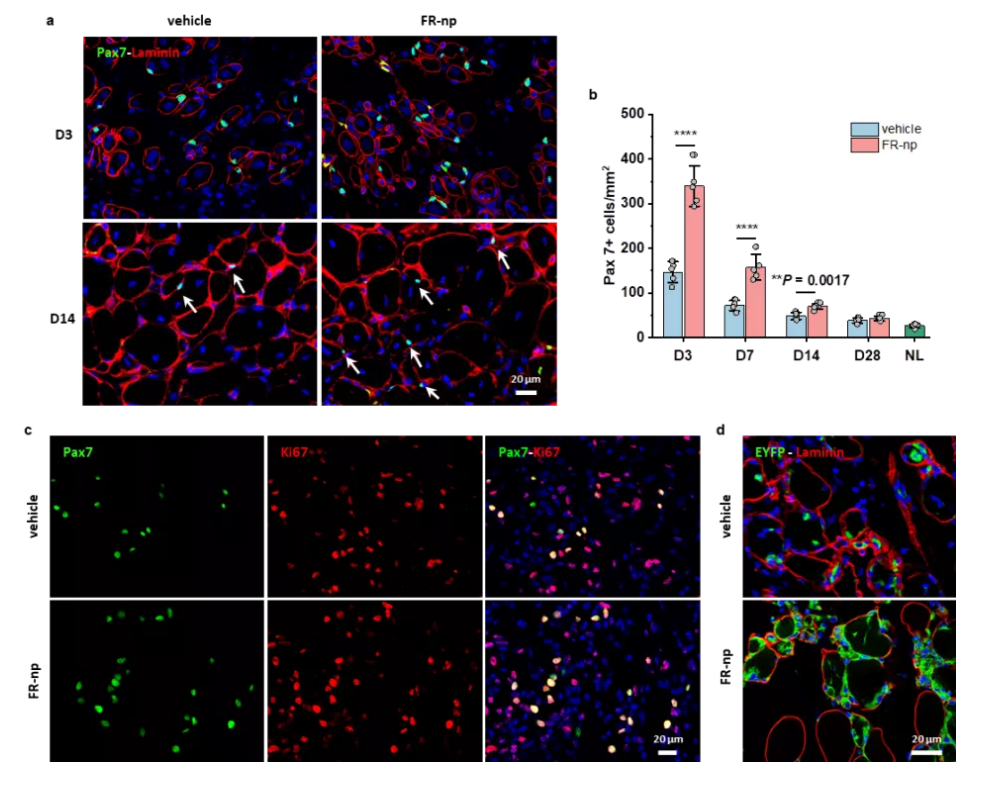
圖4. 載小分子藥物納米顆粒促進原位肌肉幹細胞
的增殖和肌肉修復
目前,研究團隊已經在老年小鼠和DMD小鼠體內進行了小分子組合藥物“雞尾酒”體外擴增幹細胞及藥物遞送原位治療損傷肌肉的研究🤘🏼,顯著地改善了受損肌肉的功能和組織再生🏅。
下一階段,研究人員計劃開展人體實驗🐦🔥,進一步探究細胞移植和藥物遞送臨床治療肌肉的效果和可行性。這一發現有望徹底解決老年性肌肉萎縮和肌肉營養不良等肌肉疾病的臨床治療難題,改善患者生存質量,具有重大的臨床意義和社會意義。
加州大學洛杉磯分校生物工程系李松教授是該研究的通訊作者➡️。李松教授是加州大學洛杉磯分校生物工程系主任。近年來主要從事細胞工程🧑🏽🦰、生物材料👨👦👦、再生工程和免疫工程等方面的研究。方俊博士和Junren Sia 博士為本文共同第一作者。
相關論文信息🧗🏿:https://dx.doi.org/10.1038/s41551-021-00696-y

方俊博士目前任加州大學洛杉磯分校李松教授團隊博士後、助理項目科學家;方博士將於2021年6月作為長聘教軌副教授(博士生導師)全職加入意昂4体育平台🖤。
方俊個人網頁🫧✥: https://www.junfanglab.com/